La llegada de la COVID-19 cambió las sociedades tal y como se conocían a escala global. El planeta se vio obligado a parar, las economías se tambalearon y la ciudadanía sufrió las consecuencias de un virus, el SARS-CoV-2, que dejó una huella imborrable en el imaginario colectivo. La ciencia, una vez superó el primer desafío al desarrollar vacunas que mitigasen los efectos de esta enfermedad, se vio obligada a seguir investigando.
Los estragos causados por la COVID-19 encendieron las alarmas y, ahora, la previsión ha pasado a ocupar un papel protagonista en los laboratorios y centros de investigación de todo el mundo. En un planeta cada vez más interconectado en el que los virus surgen y llegan a la otra punta de la Tierra en cuestión de días, detectar de forma temprana los casos de cada nuevo patógeno es crucial. Identificar las zonas en las que podrían ocurrir estas zoonosis aún más.
Por ejemplo, este estudio publicado en la revista Proceedings of the National Academy of Sciences presenta un enfoque totalmente nuevo: aunque estudios anteriores ya habían investigado cómo las variables medioambientales, filogenéticas y geográficas determinaban la infección de numerosos patógenos, ninguno había desarrollado hasta ahora un método aplicable a un gran número de sistemas en los que se crea esa relación entre patógeno y anfitrión.
Inteligencia artificial aplicada a la investigación
En el estudio, los investigadores aportan un enfoque basado en la inteligencia artificial, concretamente a través de machine learning, que puede integrar un gran número de variables y ser aplicado a cualquier sistema de relación entre patógeno y anfitrión. Es por ello que estos resultados no solo concuerdan con los datos de cada sistema analizado, sino que también aportan esta nueva herramienta que puede ayudar a descubrir especies anfitrionas potenciales y nuevos “puntos calientes” en la geografía planetaria en los que podría darse esta interacción entre patógeno y especie.

Aunque estudios anteriores ya habían investigado cómo las variables influían en la infección de numerosos patógenos, ninguno había desarrollado un método aplicable a un gran número de sistemas.
Ángel Luis Robles Fernández, de la Universidad Veracruzana de México y uno de los autores del estudio, explica la metodología en una entrevista mediante correo electrónico con National Geographic España: “este método solo usa una proporción de la información porque partimos de suponer que las interacciones observadas tienen la misma naturaleza y son explicadas con las mismas variables, por lo que se toman como punto de partida las especies con las que se cuenta más información”.
¿Cómo se integra el machine learning? Robles lo explica así: “Partimos de una hipótesis estadística y un modelo lineal generalizado, pero al combinar más variables y plantear un modelo no necesariamente lineal, el machine learning permite una predicción más precisa si el fenómeno que se modela es más complejo”, una solución que permite añadir numerosas variables para la predicción con la información realmente relevante.
Al introducir los datos de las incidencias conocidas entre patógenos y anfitriones, el algoritmo utilizado aprende por sí mismo a organizarlas para clasificarlas al detalle. “Estos procedimientos se repiten miles de veces y en ello radica el poder de hacer búsquedas de patrones usando estas herramientas de machine learning, puesto que de otra forma sería un proceso quizás menos robusto estadísticamente hablando”, afirma Andrés Lira-Noriega, otro de los autores del estudio.
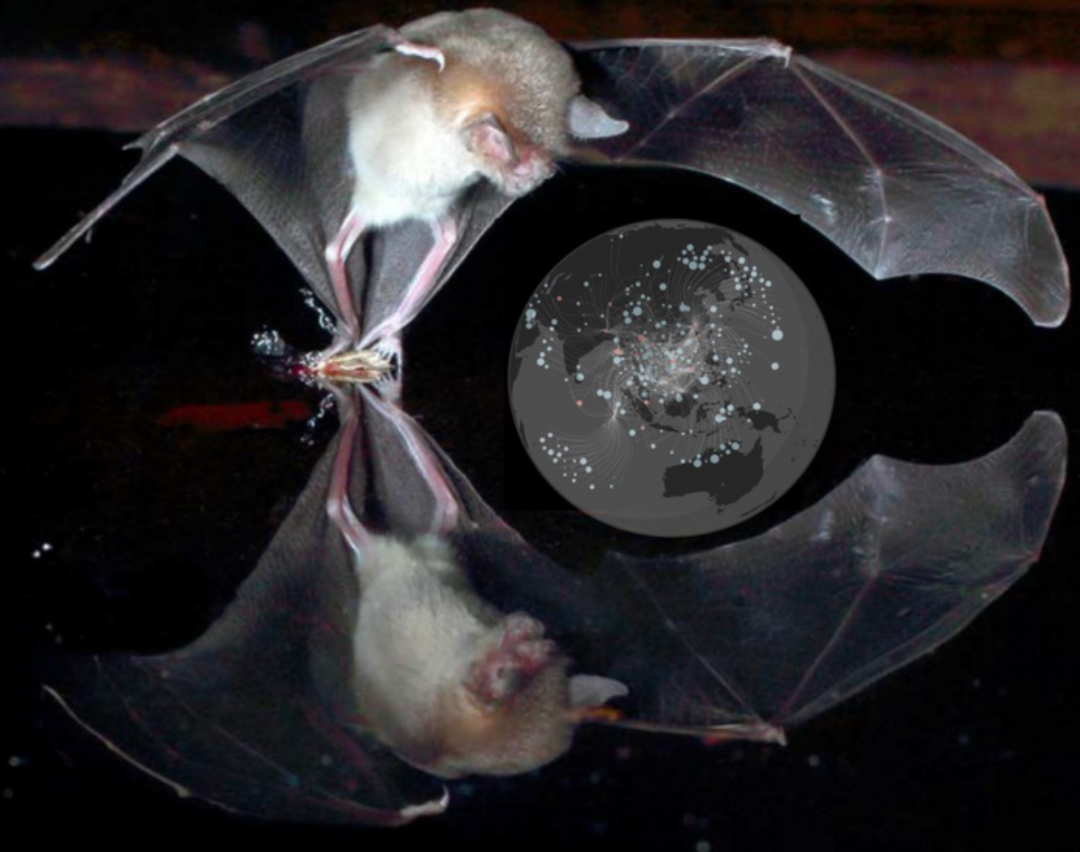
Las predicciones apuntan a Eurasia
Junto con Andrés Lira-Noriega, Investigador de la Red de Estudios Moleculares Avanzados, y Diego Santiago-Alarcón, profesor en la Universidad de South Florida, los autores aplicaron el modelo a tres sistemas de relación entre patógenos y anfitriones: los coronavirus y los murciélagos, así como el virus del Nilo-Occidental y la malaria con las aves. Sus resultados sugieren que la transmisión de la malaria aviar depende en gran medida de la distancia entre anfitriones, mientras que la transmisión de los coronavirus entre murciélagos se ve afectada principalmente por la distribución geográfica entre especies.
Por su parte, la transmisión del virus del Nilo-Occidental se ve influenciada en gran medida por una combinación de factores medioambientales, geográficos y filogenéticos. “Estamos trabajando en modelar diferentes sistemas parásito-anfitrión, pero también estamos estudiando si podemos modelar otras interacciones biológicas, no sólo parásito anfitrión, sino en general predecir interacciones biológicas”, añade Robles.
De esta información, los investigadores identificaron numerosos puntos calientes alrededor del mundo, detallando cómo la región de Eurasia es particularmente susceptible para que surjan estas interacciones con los patógenos de la malaria aviar (causada por Plasmodium relictum) y el virus del Nilo-Occidental.
Un método para predecir las pandemias del futuro
Ante la actual situación epidemiológica global, que plantea desafíos de enfermedades infecciosas como resultado del deterioro del orden natural en todo el mundo, la necesidad de anticipar nuevos riesgos ocupa un papel principal. El mejor ejemplo de ello ha sido la COVID-19.
“Este es solo un ejemplo de otras amenazas que podemos esperar y por lo tanto anticipar dichos riesgos es necesario para poder llevar a cabo acciones preventivas que nos ayuden a evitar los estragos que pueden llegar a ocasionar. Las predicciones que podemos hacer gracias este tipo de modelos y herramientas de análisis nos pueden ayudar a optimizar recursos (económicos, humanos, institucionales) así como estrategias para que los gobiernos a distintas escalas actúen de forma preventiva”, detalla Andrés Lira-Noriega.
Pero esta herramienta va un paso más allá, permitiendo la posibilidad de extrapolarla a otros sistemas de virus y anfitriones en todo el mundo, de modo que se puedan predecir donde podrían las pandemias del futuro. “Nuestra esperanza es que esta herramienta pueda usarse para tener predicciones espacial y temporalmente explícitas para explorar reservorios y vectores de múltiples patógenos. Un claro ejemplo sería su aplicación para saber qué especies de murciélagos muestrear para seguir trabajando en el desarrollo de vacunas universales para la COVID-19″, apunta Lira-Noriega.